В чем особенности симптоматики этого заболевания?
При наличии ишемического инсульта в бассейне правой среднемозговой артерии можно выявить симптоматику поражений среднего мозга и полушария главного мозга в зависимости от местонахождения и состояний коллатеральных кровоснабжений в клинических картинах. Довольно часто можно встретить сочетание поражения таламуса и мозгового полушария или же изолированные инфаркты таламуса. Следует заметить, что в большинстве случаев симптоматика заболевания у пациентов может комбинироваться. К самым распространенным симптомам можно отнести зрительное повреждение, нейропсихологическое повреждение, а также гемипарезы.
Нейропротекция
Говоря о лечении ишемического инсульта, следует также упомянуть такой вид терапии, как нейропротекцию. Основным ее направлением считается использование особых препаратов, обладающих нейротрофическими и нейромодуляторными функциями. Наиболее известным таким препаратом на сегодняшний день является церебролизин (он относится к нейротрофическому ряду препаратов). Как известно, в ЦНС и спинном мозге отсутствует такое важное свойство как депонирование. Другими словами, если приостановить в этих областях кровоток на 5 минут, то нейроны начнут погибать. Поэтому необходимость введения нейропротекторов является обязательной. Ее следует проводить в первые минуты с момента начала ишемического инсульта.
Лечение ишемического инсульта увенчается успехом при комплексном подходе: проведении базисной терапии, реабилитации, нейропротекции и реперфузии.
В чем особенности диагностики ишемического инсульта в бассейне правой средней мозговой артерии?
Стоит отметить, что зачастую компьюторные томографии не позволяют выявить любое ишемическое видоизменение в паренхимах мозга на протяжении некоторого момента от возникновения инсультов, именно то время, которое является очень важным в качестве начинания излечивания такого рода заболеваний.
Благодаря использованию магнитно-резонансных томографий становится возможным более точное определение присутствия и характера любого ишемического изменения в главном мозге в период инсультов. После получения данных после проведенной магнитно-резонансной томографии становится возможным выявление раннего ишемического видоизменения. На сегодня стало возможным комбинирование различных режимов, что дает возможность определить более резкое, подострое и врожденное ишемическое изменение в паренхимах мозга.
Основные услуги клиники доктора Завалишина:
- консультация нейрохирурга
- лечение грыжи позвоночника
- операции на головном мозге
- операции на позвоночнике
Газета «Новости медицины и фармации» Неврология (370) 2011 (тематический номер)
Фибрилляция предсердий (ФП) является одним из наиболее частых и, несомненно, социально значимых нарушений ритма сердца [16, 22, 45]. Очевидно, что распространенность ФП удваивается с каждым десятилетием после 55 лет. По данным Фремингемского исследования, распространенность ФП у пожилых мужчин увеличилась втрое за два десятилетия [11, 15, 20, 22, 23, 27, 28, 33, 35, 40, 46]. Этот рост распространенности ФП невозможно объяснить только изменениями распространенности в популяции клапанных заболеваний сердца, инфаркта миокарда или старением популяции. Ежегодная заболеваемость составляет от 5 случаев на 1000 в возрасте 50–59 лет до 45 на 1000 в возрасте 85–94 года у мужчин и от 2,5 до 30 на 1000 в этих же возрастных категориях у женщин. Различия в количестве появления новых случаев ФП с учетом пола нивелируются с увеличением возраста [17, 18, 33, 38, 39, 41]. Доказана значимость ФП для развития и прогрессирования застойной сердечной недостаточности, преждевременной смертности. ФП является причиной 1–2 % госпитализаций во всем мире [2, 3, 6, 9, 10, 43, 44]. Вместе с тем наиболее существен вклад ФП как риск-фактора в развитие ИИ, в частности его кардиоэмболического подтипа. Хорошо известно, что перенесенный инсульт, вне зависимости от его типа, значительно повышает не только риск развития острых церебральных сосудистых катастроф, но и кардиальных событий в 3–4 раза [9, 23, 35, 40]. Постоянная форма ФП различной этиологии является самой частой аритмией у пациентов с ишемическим инсультом и отмечается в 15–20 % наблюдений. Возрастные механизмы увеличения частоты развития ФП обусловлены тем, что при старении происходит прогрессирующее увеличение фиброза и жировой инфильтрации синоатриального узла. Уменьшение податливости (расслабления) миокарда приводит к увеличению предсердий, что предрасполагает к ФП. В настоящее время механизмы формирования ФП рассматриваются как результат сложного взаимодействия различных факторов, включая генетические, молекулярно-биологические, электрофизиологические, спектр которых значительно варьирует у каждого конкретного пациента, создавая многообразие патофизиологических вариантов ФП [5, 13, 22, 41, 44, 48]. Несмотря на прогрессирование фундаментальных исследований, проблема патогенеза ФП остается далекой от окончательного разрешения [13, 43]. По мнению одного из ведущих специалистов в области патофизиологии аритмий D.P. Zipes, поиски магистрального механизма развития нарушений ритма в целом и ФП в особенности, безусловно, обречены на неудачу в связи с высокой гетерогенностью их патогенеза и могут быть уподоблены безуспешным поискам «золотого руна» [8, 14, 15]. Установлено, что ФП сопровождается нарушением физиологических адаптационных возможностей сердечно-сосудистой системы, обеспечивающих стабильность кровообращения при постоянно меняющихся условиях. Это связано с повреждением регуляторного влияния автономной нервной системы на сердце. В результате не только ритм желудочковых сокращений, но и их частота не соответствуют потребностям организма в данный отрезок времени. Проявлением такого дисбаланса могут быть ухудшение сократимости миокарда левого желудочка, увеличение частоты желудочковых сокращений, снижение ударного объема левого желудочка или минутного объема сердца, а также периоды асистолии свыше 2 с [23, 35, 40, 42]. ФП приводит к уменьшению мозгового кровотока вследствие вторичной дисфункции церебральных ауторегуляторных механизмов, обусловленной ишемическим поражением мозга. Ситуация усугубляется тем, что из-за внезапности развития инсульта по механизму тромбоэмболии коллатеральные пути мозгового кровообращения практически не функционируют [20, 25, 29, 43]. Известно, что в результате развития постоянной формы ФП нарушается внутрисердечная гемодинамика, что приводит к снижению ударного индекса левого желудочка в среднем на 43 % [17, 27, 28, 30]. Церебральный кровоток вторично может уменьшаться на 23 % [15, 29, 43]. Эти нарушения могут привести к транзиторному снижению минутного объема сердца, артериального давления и мозгового кровотока [16, 29, 40, 41]. Существует мнение, что дополнительному снижению регионального мозгового кровотока при ФП способствуют сопутствующая коронарная патология и хроническая сердечная недостаточность [13, 29, 37]. Однако другие исследователи полагают, что снижение мозгового кровотока обусловлено исключительно данной аритмией [6, 10, 11, 23, 31, 47].
Локальные поражения головного мозга, в том числе острое нарушение мозгового кровообращения (ОНМК), могут привести к радикальной смене доминантного полушария и к значимым изменениям межполушарного взаимодействия. В 1988 году А.Д. Брагиной и В.Т. Доброхотовой была установлена неидентичность функциональных связей больших полушарий с регуляторными срединными образованиями мозга (более тесное функциональное взаимодействие диэнцефальных структур с правым полушарием, а ствола и гиппокампа — с левым полушарием). Существует мнение, что количество межполушарных когерентных связей в пожилом и старческом возрасте меньше, чем в молодом [14, 25]. Предполагается, что снижение межполушарной асимметрии у пожилых людей может быть связано со снижением специализации полушарий и/или пластическими перестройками, направленными на компенсацию дисфункции мозга, связанной с энергетическим дефицитом и потерей нейронов [31, 43, 44]. Изменения межполушарного взаимодействия в старческом возрасте связаны также со структурными и функциональными нарушениями в комиссуральных системах, важнейшей из которых является мозолистое тело. А.В. Леутиным и Е.К. Николаевым (2005) приводятся литературные сведения о корреляции степени асимметрии мозга, активности функционирования синусового узла сердца, меры общего напряжения сердечных регуляторных механизмов, а также о том, что при исследовании произвольной регуляции частоты пульса выявлены изменения электрической активности в передних отделах правого полушария при их отсутствии в левом. Выраженные изменения сердечного ритма регистрировались при поражении и унилатеральной инактивации правого полушария, при создании в нем доминантного очага. Существуют данные о том, что правое полушарие доминирует в обработке сердечно-сосудистой афферентации. Данные некоторых экспериментальных и клинических исследований свидетельствуют о функциональной межполушарной асимметрии мозга. Так, нарушения сердечного ритма наиболее часто встречаются при правополушарном поражении. При этом основное влияние на сердечно-сосудистую автономную регуляцию оказывают кора островка, амигдалярная область, латеральные ядра гипоталамуса. Оценка сердечно-сосудистой автономной регуляции и риска развития аритмий при поражении правого полушария с вовлечением островка была проведена F. Colivicchi et al. Наблюдение проводилось в течение года после инсульта, и первичной конечной точкой была возможная смерть пациента за этот период. На основании полученных результатов авторы считают, что возраст, тяжесть инсульта на момент поступления, наличие поражения правого островка, а также наличие желудочковой тахикардии при холтеровском мониторировании ЭКГ можно считать независимыми предикторами смертельного исхода в течение первого года после инсульта. В современной литературе встречаются лишь единичные источники, указывающие на наличие взаимосвязи системной, кардиальной и церебральной гемодинамики у пациентов, перенесших ИИ. Так, Furio Colivicchi et al. доказали, что вовлечение правого островка при поражении правого полушария может приводить к развитию аритмий с неблагоприятными прогностическими последствиями [18, 28, 30, 31, 35, 41]. По мнению A. Alga, P.C. Gates et al., отмечается увеличение случаев внезапной смерти у больных с каротидным атеросклерозом и левополушарными инфарктами мозга, а также существует связь между локализацией поражения головного мозга и кардиальными нарушениями [8, 19, 38]. Некоторые авторы отмечают, что пролонгированный интервал QT является предиктором развития жизнеопасных аритмий у пациентов с церебральной ангиопатией [18, 26, 33, 40]. R. Lane, J. Wallace et al. обнаружили взаимосвязь между правополушарным инсультом и суправентрикулярной аритмией, а также между левополушарным инсультом и желудочковыми нарушениями сердечного ритма [15, 18, 23, 35, 44].
Однако, несмотря на большой объем исследований, посвященных анализу патогенетических механизмов особенностей клинического течения и прогноза КЭИ, до настоящего времени не представлен комплексный анализ состояния и взаимоотношения церебральной, кардиальной и системной гемодинамики у больных, перенесших КЭИ, с учетом полушарной локализации ишемического очага (ИО). В то же время при разработке стратегии терапии и реабилитации больных КЭИ важным аспектом являются комплексные корреляции мозгового кровотока и нарушения гемодинамики у данной категории пациентов. Это определяет целесообразность проведения комплексного анализа состояния системной, кардиальной и церебральной гемодинамики у больных, перенесших КЭИ, с учетом полушарной локализации ИО.
Материалы и методы
В исследовании приняли участие 119 пациентов пожилого и старческого возраста, перенесших КЭИ в каротидном бассейне на фоне постоянной формы ФП, которые были разделены на 2 группы с учетом полушарной локализации ИО: 44 пациента с локализацией ИО в левом полушарии, 42 — в правом полушарии головного мозга и 33 лица пожилого и старческого возраста с постоянной формой ФП. Группы были сопоставимы по возрасту, полу, индексу массы тела, давности ФП, давности АГ и КЭИ. Критериями отбора больных была верификация кардиоэмболического инфаркта мозга в каротидном бассейне (по данным анамнеза, клинического обследования и результатам магнитно-резонансной томографии). Средний возраст обследованных пациентов — 72,7 ± 5,8 года.
Все больные проходили комплексное клинико-инструментальное обследование, которое включало общеклиническое, клинико-неврологическое обследование, трансторакальную эхокардиографию, холтеровское мониторирование ЭКГ и АД и исследование мозгового кровотока методом ультразвукового дуплексного сканирования экстра- и интракраниальных отделов магистральных артерий головы и шеи на аппарате Philips EnVisor (Philips) на фоне базисной медикаментозной терапии в соответствии с рекомендациями Европейской ассоциации кардиологов по ведению пациентов с АГ, ФП (ингибиторы АПФ, блокаторы бета-адренорецепторов, антикоагулянты (варфарин) при отсутствии противопоказаний).
Статистическую обработку данных проводили с помощью программного обеспечения Statistica 6.0. Рассчитывали среднее значение, ошибку среднего и статистическую значимость с помощью параметрического метода (t-критерий Стьюдента) для независимых групп с учетом того, что распределение признаков соответствовало закону нормального распределения и дисперсии распределений признаков в двух сравниваемых группах были равны. В случае, если выборка не отвечала законам нормального распределения, для определения статистической значимости результатов использовали непараметрический метод (c2 Пирсона).
Результаты и обсуждение
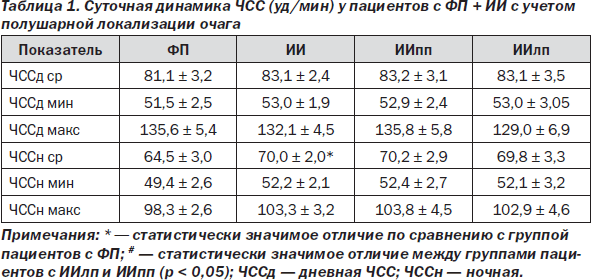
Сравнительный анализ частоты сердечных сокращений (ЧСС) у пациентов, перенесших КЭИ, и у пациентов с ФП без КЭИ продемонстрировал отсутствие статистически значимых различий между группами пациентов (табл. 1).
Учитывая отсутствие возможности оценить вегетативную регуляцию сердечной деятельности по вариабельности ритма сердца, нами был использован такой показатель, как циркадный индекс (ЦИ). Обращает на себя внимание некоторое снижение величины ЦИ у пациентов, перенесших ИИ. Он был ниже нормальных значений (124–144) и статистически значимо ниже по сравнению с пациентами с ФП как в совокупной выборке пациентов, перенесших ИИ, так и у пациентов с локализацией ишемического очага в правом полушарии. Можно полагать, что снижение ЦИ у больных с КЭИ на фоне ФП обусловлено поражением интракардиальной нервной проводимости. Снижение ЦИ клинически ассоциировано с высоким риском развития жизнеугрожающих аритмий и внезапной смерти [1, 4, 33].
При анализе желудочковых нарушений ритма в общей выборке пациентов с ИИ обнаружено, что как в группе пациентов с ФП + ИИ, так и в группе пациентов с ФП в 100 % случаев наблюдались одиночные желудочковые экстрасистолы (ОЖЭ). Необходимо отметить, что практически у 30 % пациентов с ФП вне зависимости от наличия ИИ зарегистрированы полиморфные, политопные ОЖЭ и их количество превышало 10 в час.
Парные желудочковые экстрасистолы (ПЖЭ) чаще наблюдались у пациентов с ФП + ИИ, а частота встречаемости групповых желудочковых экстрасистол (ГЖЭ) в 3,5 раза была выше у пациентов с ФП. Пароксизмы желудочковой тахикардии (ПЖТ) были более характерны для пациентов с ФП + ИИ — наблюдались в 3 раза чаще, чем у пациентов с ФП без ИИ (рис. 1).
Анализ частоты желудочковых нарушений ритма с учетом полушарной локализации показал, что у пациентов с ИИпп ПЖЭ и ПЖТ встречались в 2 раза чаще, чем у пациентов с ИИлп.
Таким образом, необходимо отметить, что желудочковые нарушения ритма на фоне ФП в целом чаще наблюдались у пациентов с ИИ, в частности перенесших ИИ с локализацией в правом полушарии.
В обследуемых группах желудочковые нарушения ритма сочетались с латентными нарушениями проводимости. Паузы более 2 секунд, свидетельствующие о наличии скрытого АВ узлового проведения [3], встречались у пациентов данных групп с одинаковой частотой: 63 % у пациентов с ФП и 65 % — с ИИ. Однако отмечается некоторое различие в частоте пауз более 2 секунд с учетом полушарной локализации ИО: паузы чаще наблюдались у пациентов с ФП + ИИпп по сравнению с пациентами с ФП + ИИлп (71 и 59 % соответственно, р < 0,05). Установлена статистически достоверная обратная корреляционная связь между ЦИ и наличием пауз длительностью более 2 с у пациентов с ФП + ИИпп (r = –0,46; р < 0,05), что свидетельствует о наличии сопряженности ригидности ритма и латентного АВ узлового проведения при правосторонней локализации ишемического очага.
Следует обратить особое внимание на высокую частоту встречающихся эпизодов удлинения интервала QTc у пациентов с КЭИ. Хорошо известен неблагоприятный прогноз данного феномена для развития жизнеугрожающих желудочковых аритмий [4]. Проведен анализ таких показателей, как время удлинения QTс, значение интервала QT, QTс, причем приняты во внимание суточная динамика данных показателей, а также средние, максимальные и минимальные значения. Установлено, что у пациентов с ИИпп время удлинения QTс за сутки в среднем составляет 5,0 ± 0,6 часа, что на 40 % выше по сравнению с пациентами с ФП, у которых данная величина составляет 3,6 ± 0,6 часа (р < 0,05). В целом удлинение интервала QTс у пациентов с ФП, как перенесших ИИ, так и без ИИ, наблюдалось с высокой частотой — у около 60 % обследуемых пациентов.
Таким образом, пациенты только с ФП и с ФП, перенесшие острый ишемический инсульт, характеризуются высокой частотой желудочковых аритмий. Имеется зависимость между локализацией ИИ и характером и выраженностью желудочковой эктопической активности: при поражении правого полушария преобладают ПЖЭ и ПЖТ, частота которых более чем в 2 раза выше по сравнению с пациентами с левосторонней локализацией ИО. Увеличение продолжительности интервала QTc как маркера развития жизнеугрожающих желудочковых аритмий и внезапной смерти регистрировалось у 60 % пациентов с ФП вне зависимости от наличия ИИ и его полушарной локализации. Наибольшее время удлинения интервала QTc наблюдалось у пациентов с ФП и правополушарной локализацией ишемического очага, у которых установлена прямая зависимость между временем удлинения QTc и желудочковой эктопической активностью. Наличие скрытого АВ узлового проведения встречалось у 65 % пациентов с ФП, как с ИИ, так и без ИИ. Установлена сопряженность ригидности ритма с латентным АВ узловым проведением у пациентов с ФП + ИИпп. Эпизоды ишемии миокарда чаще наблюдались у пациентов с ФП без ИИ. Пациенты с локализацией очага в правом полушарии характеризовались преобладанием более тяжелых градаций желудочковых аритмий, выраженностью и частотой удлинения интервала QTc, ригидностью сердечного ритма и его тесной сопряженностью с латентными нарушениями АВ-проведения и ишемией миокарда.
В последние годы суточное мониторирование артериального давления (СМАД) является более распространенным методом функциональной диагностики преимущественно в кардиологии и недостаточно используется в неврологии. Данный метод дает возможность оценить не только средние, максимальные и минимальные значения систолического АД (САД) и диастолического АД (ДАД) в разное время суток, но и выявить наличие или отсутствие эпизодов гипертензии и гипотензии, проанализировать оценку выраженности гипертензии по индексу времени (ИВ) и индексу площади (ИП), оценить циркадную динамику и вариабельность АД, что имеет немаловажное значение для стратификации риска развития ИИ, особенно при наличии такого нарушения ритма сердца, как постоянная форма ФП.
В зависимости от степени изменения давления ночью выделяют различные типы суточного профиля АД: dipper, non-dipper, night-picker и over-dipper. При анализе суточного профиля у пациентов с ФП и ИИ без учета полушарной локализации очага было обнаружено, что только для 35 % пациентов с ФП вне зависимости от наличия или отсутствия ИИ характерно физиологическое снижение АД в ночное время, и почти у 70 % пациентов в обеих группах были обнаружены отклонения в циркадной динамике АД. В группах преобладали non-dipper, которые встречались чаще среди пациентов с ФП без ИИ. Приблизительно у каждого шестого пациента наблюдался тип night-picker. Большая группа пациентов была представлена типом over-dipper. Оказалось, что соотношение пациентов данного типа различалось по группам: у пациентов с ФП без ИИ over-dipper в 1,3 раза встречался чаще, чем у пациентов с ИИ на фоне ФП. Причем по соотношению САД и ДАД over-dipper и night-picker распределялись, как представлено на рис. 2. Более характерным являлось снижение ДАД по сравнению с САД.
В то же время повышение АД ночью характеризовалось преобладанием в 3,5 раза пациентов в группе ФП и ИИ, у которых одновременно было повышено и САД, и ДАД.
При анализе циркадной динамики АД у пациентов с ИИ на фоне ФП с учетом полушарной локализации очага оказалось, что, несмотря на то, что выраженные отличия по средним величинам между группами отсутствуют, тип dipper в 1,7 раза чаще встречался у пациентов с ИИлп, а non-dipper — в 2 раза чаще у пациентов с ИИпп (рис. 2).
В целом неблагоприятный профиль циркадной динамики АД наблюдался практически у 60 % пациентов с ИИлп, а в группе ИИпп — у 74 %. Среди over-dipper и night-picker сохранялась та же тенденция, которая наблюдалась при сравнении групп без учета полушарной локализации. Таким образом, главное отличие в циркадной динамике АД между группами пациентов с ИИлп и ИИпп заключалось в соотношении типов non-dipper и dipper.
Общеизвестно, что гипертрофия левого желудочка (ГЛЖ), развивающаяся вследствие АГ, является независимым фактором риска развития не только кардиоваскулярных осложнений и смертности, но и острого нарушения мозгового кровообращения [7–9, 11, 13]. Развитие ГЛЖ приводит к электрической негомогенности миокарда вплоть до развития аритмий, из которых наиболее значимой является фибрилляции предсердий (ФП) [1, 3, 4, 6, 10, 14]. Известно, что появление ФП вызывает снижение основных гемодинамических показателей. Однако, несмотря на значимость вышесказанного, публикации, посвященные проблеме исследования структурно-функционального состояния сердца у пациентов с постоянной формой ФП, перенесших ОНМК, малочисленны [7–9].
По соотношению видов гипертрофии ЛЖ: так, эксцентрический тип гипертрофии миокарда ЛЖ наиболее часто встречался у пациентов с ФП без ИИ (48 %), а концентрическое ремоделирование ЛЖ — у пациентов с ФП + ИИпп (р < 0,05). При этом у пациентов с ФП + ИИпп не наблюдалось эксцентрического типа геометрии ЛЖ, а у пациентов, перенесших ИИ, концентрическое ремоделирование встречалось в 2 раза чаще, чем у пациентов с ФП без ИИ. Следует отметить, что концентрический тип ГЛЖ, самый неблагоприятный в отношении прогноза, встречался одинаково во всех группах приблизительно у 50 % пациентов, и практически у четверти пациентов в каждой группе не было ГЛЖ (рис. 3). Анализ взаимосвязи между типом ремоделирования ЛЖ, характером системной гемодинамики и размерами ЛП не показал статистически значимых различий.
Для больных КЭИ, у которых имеется сочетанное поражение мозговых сосудов и кардиальные нарушения, важным является проведение комплексного анализа показателей мозгового кровообращения и функционального состояния сердца. Такой комплексный, системный подход информативен, так как дает возможность расширить представления о патогенетических механизмах формирования различных типов КЭИ и разработать пути сочетанной коррекции гемодинамических нарушений у данной категории больных. Однако до настоящего времени такой методический подход к проблеме КЭИ недостаточно используется. Все вышесказанное определило целесо- образность изучения у больных с ФП, перенесших КЭИ, состояния мозгового кровотока. Критерием оценки уровня и степени изменения мозгового кровообращения у больных с КЭИ были показатели ЛССК, периферического сопротивления, эластичности сосудов каротидного и вертебробазилярного бассейнов (ВББ), размеры КИМ, частота и степень стенозов, структура атеросклеротических бляшек. Основным ультразвуковым показателем, позволяющим косвенно оценить наличие структурной перестройки сосудистой стенки, является состояние комплекса интима-медиа (толщина, эхогенность, степень дифференцировки на слои). У 80,6 % обследованных нами пациентов с локализацией ишемического очага в правом полушарии и у 73,3 % с локализацией в левом отмечается относительно равномерное повышение эхогенности КИМ ОСА с двух сторон с частичной утратой дифференцировки его на слои (1,13 ± 0,03 и 1,12 ± 0,03 соответственно).
Согласно представленным данным, у больных с локализацией ишемического очага в правом и левом полушарии в пораженных ОСА величина комплекса интима-медиа статистически значимо не различается. В то же время у пациентов всех групп КИМ превышает норму (нормальное значение — 1,0 мм).
Принимая во внимание значительную роль стенозирования в развитии ишемического инсульта и корреляцию степени стенозирования и риска развития ишемии мозга, нами была проанализирована частота различных степеней стенозирования у больных, перенесших ишемический инсульт.
Согласно полученным данным, частота стенозов экстракраниальных сосудов каротидного бассейна до 50 % у больных с локализацией ишемического очага в правом и левом полушарии как в гомолатеральных, так и в гетеролатеральных сосудах не различалась (38, 50, 57, 60 % соответственно). В то же время частота стенозов 50–75 % как в гомо-, так и в гетеролатеральных очагу экстракраниальных сосудах каротидного бассейна статистически значимо выше у больных с локализацией ишемического очага в правом полушарии — более чем в 2 раза (33 и 14 % соответственно).
В механизмах формирования мозговой ишемии значительную роль играет не только степень стенозирования сосуда, но и морфология атеросклеротической бляшки, характеристика ее поверхности. Ультразвуковое дуплекс-ное сканирование позволяет охарактеризовать бляшки сонной артерии по эхогенности, что дает возможность предположительно установить ее морфологический состав. Согласно критериям Европейской группы исследователей по эхоплотности, различают следующие бляшки сонных артерий: гиперэхогенные, промежуточные и гипоэхогенные. Морфологическим субстратом гипоэхогенных бляшек являются молодые соединительнотканные элементы, липиды и клетки крови. Такой тип атеросклеротической бляшки способен быстро расти, что приводит к значительному сужению сосуда или его полной окклюзии и свидетельствует об агрессивной форме атеросклероза.
Учитывая высокую агрессивность гипоэхогенных бляшек, следует обратить внимание на более высокий процент выявления при УЗДС гипоэхогенных бляшек у больных с локализацией ишемического очага в правом полушарии (46 % по сравнению с 29 % у пациентов с левополушарным инсультом). Частота гетерогенных бляшек, которые являются менее агрессивными, однако в их структуре имеется гипоэхогенный компонент, в сосудах каротидного бассейна у больных с локализацией ишемического очага в правом и левом полушариях статистически значимо не различается (46 и 32 % соответственно).
На основании представленных данных следует отметить, что анализ частоты и структуры атеросклеротических бляшек выявил выраженные межполушарные различия: чаще агрессивные атеросклеротические бляшки встречаются у пациентов с локализацией ИО в правом полушарии.
Сравнительный анализ ЛССК с учетом полушарной локализации ИО показал, что у пациентов с локализацией ИО в правой гемисфере в экстракраниальных сосудах пораженного полушария каротидного бассейна более выражено снижение ЛССК, чем у пациентов с левополушарным инсультом. Так, у пациентов с правополушарным инсультом ЛССК в ОСА 53,63 ± 2,06 см/с и в ВСА 47,13 ± 2,42 см/с, а у пациентов с левополушарным инсультом соответственно 58,59 ± 2,40 см/с и 51,32 ± 2,29 см/с. В соответствующих сосудах интактного полушария каротидного бассейна отмечается обратная зависимость: у пациентов с правополушарным инсультом выше ЛССК, чем у пациентов с левополушарным инсультом (у пациентов с правополушарным инсультом ЛССК в ОСА составила 77,80 ± 6,01 см/с, в ВСА — 62,34 ± 4,11 см/с; у пациентов с левополушарным инсультом ЛССК в ОСА — 52,97 ± 2,83 см/с, в ВСА — 48,61 ± 2,76 см/с).
Такие полушарные особенности изменения скоростей характерны и для ЛССК в интракраниальных сосудах пораженного и интактного полушарий каротидного бассейна. У пациентов с правополушарным инсультом выше ЛССК в ПМА и СМА (в пораженном полушарии ЛССК в ПМА составляет 73,45 ± 2,35 см/с, в СМА — 79,49 ± 5,24 см/с, в интактном полушарии соответственно 67,6 ± 6,17 см/с и 84,19 ± 4,06 см/с) пораженного и интактного полушарий, чем у пациентов с левополушарным инсультом, у которых ЛССК в ПМА составляет в пораженном полушарии 55,9 ± 4,59 см/с, в интактном 57,3 ± 5,92 см/с; в СМА соответственно 77,09 ± 4,03 см/с и 76,72 ± 4,14 см/с.
Полушарные различия отмечены и по скоростным показателям ЛССК в сосудах ВББ. У больных с правополушарным инсультом ЛССК несколько выше в левой ПА (31,31 ± 1,59 см/с) и ОА (47,77 ± 3,58 см/с), чем у пациентов с левополушарным инсультом (соответственно 27,98 ± 2,27 см/с и 41,45 ± 1,85 см/с).
Таким образом, у пациентов с левополушарным инсультом более выражено снижение ЛССК в экстра- и интракраниальных сосудах каротидного бассейна и в некоторых сосудах ВББ по сравнению с пациентами с правополушарным инсультом.
При сравнении показателей периферического сопротивления и эластичности сосудов у пациентов с право- и левополушарным инсультами между собой отмечены статистически значимые отличия для показателя периферического сопротивления сосудов в ПА интактного полушария и для показателя пульсаторного индекса в СМА интактного полушария и БА у пациентов, перенесших ИИ в правом полушарии.
Итак, у пациентов с локализацией ИО в левом полушарии по сравнению с пациентами с ФП снижается кровоток в интракраниальных сосудах каротидного бассейна (ПМА, СМА) пораженного и интактного полушарий и в ВББ (ПА, ОА). У пациентов с локализацией ИО в правом полушарии по сравнению с пациентами с ФП снижается кровоток только в пораженном полушарии СМА и ОА на фоне компенсаторного повышения кровотока в экстракраниальных сосудах каротидного бассейна (ВСА, ОСА) и ПМА пораженного полушария. Тогда как у пациентов с ФП снижена скорость кровотока в сосудах каротидного бассейна при одновременном повышении в сосудах ВББ, что является отражением формирования компенсаторных механизмов, направленных на поддержание определенного уровня мозгового кровотока и осуществляемых за счет непораженного бассейна.
Какова процедура излечивания ишемического инсульта в бассейне правой средней мозговой артерии?
Для начала стоит заметить, что процесс излечивания является достаточно долгим и требует терпения со стороны пациенток. В самом начале процесса излечивания следует нормализовать образ жизнедеятельности, посещать реабилитационные мероприятия. К двигательному процессу реабилитации можно отнести силу и ловкость в каждой конечности, навыки самообслуживаний, все это может быть реабилитированным в полной мере или частично. К речевому процессу реабилитации относят каждое занятие со специалистами, в частности с логопедами и нейропсихологами, каждое упражнение необходимое для восстановления обыкновенных нарушений чтения или счета. Что касается психологических и социальных процессов излечивания, то следует создавать здоровый климат в семьях, участия в любом культурном мероприятии в пределах кругов общения.
Довольно часто специалисты такой сферы деятельности назначают своим пациентам употреблять различного рода антидепрессанты, которые подбираются индивидуально для каждого пациента. Этому следует уделять большое внимание, ведь используя собственные предположения по принятию антидепрессантов может привести лишь к появлению различных осложнений и побочных эффектов, которые могут спровоцировать нежелательные последствия. Именно поэтому лишь лечащий врач может назначить период приема препаратов и непосредственную дозировку. Использование антиагрегатов позволяет снизить риск повторения инсульта, а в случаях отсутствия терапий заболевание может так же вернуться.
Первая помощь при инсульте
При инсульте наиболее важно доставить человека в специализированную больницу как можно быстрее, желательно в течение первого часа после обнаружения симптомов. Следует учитывать, что не все больницы, а только ряд специализированных центров приспособлен для оказания правильной современной помощи при инсульте. Поэтому попытки самостоятельно доставить больного в ближайшую больницу при инсульте зачастую неэффективны, и первым действием является звонок в экстренные службы для вызова медицинского транспорта.
До приезда скорой помощи важно не давать больному есть и пить, поскольку органы глотания могут оказаться парализованными, и тогда пища, попав в дыхательные пути, может вызвать удушье. При первых признаках рвоты голову больного поворачивают на бок, чтобы рвотные массы не попали в дыхательные пути. Больного лучше уложить, подложив под голову и плечи подушки, так чтобы шея и голова образовывали единую линию, и эта линия составляла угол около 30° к горизонтали. Больному следует избегать резких и интенсивных движений. Больному расстегивают тесную мешающую одежду, ослабляют галстук, заботятся о его комфорте.
В случае потери сознания с отсутствующим или агональным дыханием немедленно начинают сердечно-лёгочную реанимацию. Её применение многократно увеличивает шансы больного на выживание. Определение отсутствия пульса больше не является необходимым условием для начала реанимации, достаточно потери сознания и отсутствия ритмичного дыхания. Ещё больше увеличивает выживаемость применение портативных дефибрилляторов: будучи в общественном месте (кафе, аэропорт, и т. д.), оказывающим первую помощь необходимо осведомиться у персонала о наличии у них или поблизости дефибриллятора.
Лечение
Лечение инсульта включает комплекс мероприятий по неотложной помощи и длительный восстановительный период (реабилитацию), проводимый поэтапно.
Лечение инсульта должно быть направлено на восстановление поврежденных участков нервной ткани и защиту нервных клеток от распространения так называемой «сосудистой катастрофы». Восстановление поврежденных участков осуществляют с помощью группы специальных препаратов — нейрорепарантов. А здоровые нервные клетки защищают препараты-нейропротекторы. Определённые препараты успешно объединяют в себе оба указанных эффекта, поэтому могут применяться для комплексной терапии инсульта. Для восстановления утраченных функций организма пациенту могут быть назначены лечебная физкультура, массажи, выполнение логопедических и других упражнений.
Неотложная помощь
На догоспитальном этапе оказания медицинской помощи следует оценить параметры гемодинамики больного, в том случае если наблюдается выраженное повышение артериального давления (больше 220/120 мм.рт.ст.) следует принять меры к его снижению постепенно. Быстрое снижение давления приведет к ухудшению состояния больного и потери перфузии головного мозга.
При инсульте наиболее важно доставить человека в больницу как можно быстрее, желательно в течение первого часа после обнаружения симптомов. Следует учитывать, что не все больницы, а только ряд специализированных центров приспособлены для оказания правильной современной помощи при инсульте. Поэтому попытки самостоятельно доставить больного в ближайшую больницу при инсульте зачастую неэффективны.
До приезда скорой помощи важно не давать больному есть и пить, поскольку органы глотания могут оказаться парализованными, и тогда пища, попав в дыхательные пути, может вызвать удушье.
При первых признаках рвоты голову больного поворачивают на бок, чтобы рвотные массы не попали в дыхательные пути. Больного лучше уложить, подложив под голову и плечи подушки, так чтобы шея и голова образовывали единую линию, и эта линия составляла угол около 30° к горизонтали. Больному следует избегать резких и интенсивных движений. Больному расстегивают тесную мешающую одежду, ослабляют галстук, заботятся о его комфорте.
Реанимационные мероприятия
Постановка правильного диагноза и обнаружение точного места возникновения инсульта, а также данные объёма повреждённых тканей позволяют правильно выбрать тактику лечения и избежать более тяжёлых последствий. Помимо опроса и осмотра пациента необходимы специальные обследования как головного мозга, так и сердца и сосудов.
Реанимационные мероприятия должны быть направлены на поддержание адекватных показателей гемодинамики и оксигенации.
Фармакотерапия
Препараты назначаются согласно стандартам лечения и по решению лечащего врача.
Особенности ухода за пациентом
К инсульту часто присоединяются пневмония и пролежни, что требует постоянного ухода, переворачивания со стороны на сторону, смены мокрого белья, кормления, очищения кишечника, вибромассажа грудной клетки.
Постинсультная реабилитация
В мировой практике восстановительного лечения после инсульта ведущее место занимает междисциплинарный подход, исходя из которого процессом лечения (терапии) руководят несколько специалистов, в основном физиотерапевт, эрготерапевт, логопед.
- Физиотерапевт занимается восстановлением двигательных функций.
- Эрготерапевт занимается адаптацией человека после инсульта к повседневной жизни.
- Логопед занимается восстановлением речи и глотания (при наличии у больного афазии и дисфагии).
Мозг человека отличается определённой естественной способностью к восстановлению, благодаря созданию новых связей между здоровыми нейронами и формированию новых информационных цепей. Подобное свойство головного мозга носит название нейропластичность и может быть стимулировано в процессе реабилитации. Одним из ключевых факторов эффективности любой программы реабилитации является регулярное выполнение тщательно организованного, индивидуально подобранного комплекса упражнений — то есть общий принцип обучения человека новому навыку.
К новым методам реабилитации относятся роботизированные виды лечения, например, HAL-терапия, которые путём многократного целенаправленного повторения движений способствуют активизации механизма нейропластичности.
При реабилитации в постинсультный период применяют различные вспомогательные методы, в частности фармакологические, лечебную гимнастику, упражнения с биологической обратной связью (по разным реакциям, в том числе по ЭЭГ, ЭКГ, дыханию, по движениям и опорной реакции);
В 2021 году российские ученые объявили о том, что им удалось разработать стоматологический аппарат, который способствует восстановлению речи больного, перенесшего инсульт.
В постинсультном периоде высок риск возникновения постинсультной депрессии (ПД). Она оказывает негативное влияние на процесс реабилитации, качество жизни, соматическое здоровье, способствует манифестации сопутствующих психических заболеваний (в первую очередь тревожных расстройств). ПД существенно ухудшает прогноз выживаемости. Так пациенты с ПД умирают в среднем в 3,5 раза чаще в течение 10 лет после инсульта, чем больные без симптомов депрессии. По статистике, распространенность ПД составляет 33 %, в среднем ей подвержен каждый третий больной, перенесший инсульт.
Среди психических факторов, влияющих на возникновение постинсультной депрессии, отмечаются премобидные особенности личности, отношение пациента к своему заболеванию. С депрессией после инсульта связаны такие факторы как речевые проблемы, социальная изоляция, плохое функциональное состояние. ПД также может иметь органическую природу возникновения и определяться локализацией мозгового поражения. Есть мнение, что выраженность депрессии выше при локализации инсульта в лобной доле и базальных ганглиях левого полушария. Депрессия может также быть ответом на лекарственную терапию.
Лечение ПД осуществляется посредством антидепрессантов, психостимуляторов, электросудорожной терапии (особенно при лекарственной непереносимости и тяжелой, рефракторной к лечению депрессии), транскраниальной магнитной стимуляции, когнитивно-поведенческой психотерапии.
Цифры и факты
- В России ежегодно регистрируется более 400 000 инсультов, летальность при которых достигает 35 %.
- Общий риск повторного инсульта в первые 2 года после первого инсульта составляет от 4 до 14 %.
- При увеличении введения калия с пищей (картофель, говядина, бананы) отмечено достоверное снижение артериального давления у лиц с его умеренно повышенными показателями на 11,4/5,1 мм рт. ст.
- У больных, длительно получавших диуретики (мочегонные), формируется гипокалиемия (диагностируемая при концентрации калия менее 3,5 ммоль/л) и увеличение частоты сердечно-сосудистых осложнений.
- При увеличении суточного потребления калия на 10 ммоль (например, при приёме препарата калия и магния аспарагинат) риск развития инсульта с летальным исходом снижается на 40 %.