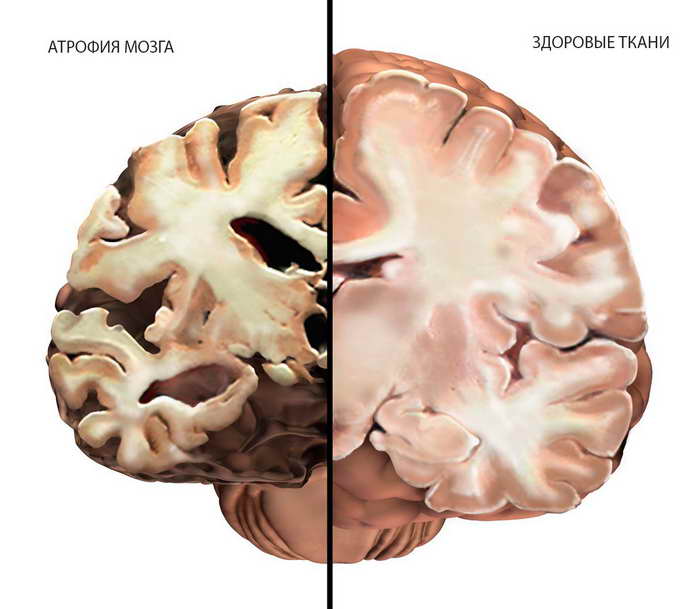
Редким и тяжелым дегенеративным заболеванием головного мозга является мультисистемная атрофия. Ранее врачи выделяли несколько форм недуга с развитием паркинсонизма, нарушением вегетативной системы и атаксией. Теперь ученые объединили их в одну нозологию под названием «мультисистемная атрофия».
Каким атрофиям подвергается мозг?
При этой болезни «умирают» клетки коры и подкоркового вещества, истончаются миелиновые волокна, гибнут нейроны и их окончания (аксоны). Атрофия головного вещества – это следствие травмы, интоксикации и гипоксии.
Если процесс дегенерации уже запущен, то болезнь приводит к летальному исходу. При церебральном поражении головного мозга продолжительность жизни резко сокращается. От появления первых симптомов до смерти проходит 5-7 лет.
Важно! Сколько проживут люди с отмиранием клеток мозга? Все зависит от локализации очагов поражения.
Мультисистемная атрофия сопровождается дегенерацией клеток базальных ганглиев, вегетативных центров и мозжечка. Поражение этих участков обуславливает картину заболевания. Такая полисистемная дегенерация головного вещества дает клинику паркинсонизма, нарушения вегетативных функций и шаткую атаксическую походку. Вся эта симптоматика и называется «мультисистемная атрофия», хотя раньше выделялось три отдельных заболевания.
Отмирание коры головного мозга – это необратимый процесс. Мультисистемная атрофия стартует с симптоматики паркинсонизма. Стриатронигральная дегенерация дает клинику ригидности мышц, тремора, постуральных нарушений. Нередко при этом ее принимается за болезнь Паркинсона.
Что это такое: корковая атрофия головного мозга? «Кора» имеет сложное строение и отвечает за высшую нервную деятельность. Каждая ее часть имеет свою функцию. Где-то хранится профессиональная память, способность создавать музыку, разговаривать и видеть. При атрофии головного мозга выпадают функции высшей нервной деятельности в зависимости от локализации поражения.
Атрофия головного вещества делится на корковую и подкорковую. При мультисистемном поражении происходит разрушение стриатонигрального пути, вегетативных центров и начинается атрофия мозжечка, что приводит к прогрессированию симптомов паркинсонизма и снижению продолжительности жизни. МСА не имеет эффективного лечения и действенной профилактики.
Виды атрофий: алкогольная, мультисистемная, кортикальная
При аутопсии у пациентов с алкоголизмом обнаруживается атрофия головного вещества: коры и подкорковых структур. Самой чувствительной зоной являются лобные доли. В них сосредоточены центры, ответственные за поведение, эмоции, интеллект. Атрофия головного мозга на фоне приема алкоголя приводит к утрате этих функций и распаду личности.
Синдром Шая-Дрейджера, оливо-понто-церебеллярная дегенерация и стриатонигральная дегенерация ранее рассматривались, как три отдельные нозологии. Но сейчас они объединены в одну форму болезни, которую вызывает МСА. Причины, лечение и профилактика неизвестны. Эта болезнь приводит к гибели пациента через 5-7 лет.
При кортикальном поражении развивается самая тяжелая форма недуга. Может пропадать зрение (поражение затылочных долей), слух (поражение височной коры). Болезнь ведет к нарушению высшей нервной деятельности.
Теряется память, интеллект, нарушается поведение (поражение лобной коры). Она заканчивается распадом личности. Патология с преимущественным поражением коры неминуемо ведет к смерти.
Диффузная, мозжечковая и задняя кортикальная атрофии головного мозга
При диффузном типе болезни характерно разлитое нелокализованное поражение. Дегенерация вещества может идти сразу в нескольких структурах (мозжечок, ствол, кора, базальные ганглии). При этом заболевании нет четкой клиники. Диагностика болезни затруднена. Характерные признаки на МРТ: уменьшение объема коры, расширение желудочков, диффузные очаги поражения подкорковых структур. Чаще развивается при интоксикационных состояниях.
Церебеллярные нарушения могут идти отдельно от мультисистемного поражения. Они появляются на фоне перенесенного инсульта, опухоли и травмы и затрагивает только мозжечок. У пациента выявляют нарушения координации, походка становится шаткой, пропадает четкость движений рук и ног. Характерный симптом – движения, как у пьяницы.
Старческая деменция с нарушениями в коре затылочно-теменных отделов является разновидностью болезни Альцгеймера. Болезнь приводит к появлению проблем со зрением. Недуг начинается с появления иллюзий, зрительных галлюцинаций и приводит к полной потере зрения.
Симптомы
У 90% лиц, страдающих этой болезнью, развивается паркинсонизм
Заболевание дебютирует обычно в возрасте 45–60 лет. Характерная клиническая картина мультисистемной атрофии включает комплекс признаков:
- Паркинсонизм, обусловленный дегенерацией всего стриатонигрального дофаминэргического комплекса. Возникает у 90% заболевших и нередко имитирует симптоматику болезни Паркинсона, что может стать причиной диагностических ошибок. Появляется тремор, замедляется скорость движений и снижается их амплитуда при повторах, повышается мышечный тонус с развитием ригидности. Возможно присоединение дистоний и дискинезий, с вовлечением торса, конечностей, лицевой мускулатуры.
- Пирамидный синдром, развитие которого связано с поражением тонких миелиновых волокон кортикоспинального пути (тракта). При неврологическом осмотре выявляются патологические стопные знаки, отмечается оживление основных сухожильных рефлексов и расширение зон их вызывания.
- Быстро прогрессирующая вегетативная недостаточность. Ее разносторонность и выраженность объясняется поражением и сегментарной, и надсегментарной (центральной) части парасимпатической и симпатической нервной системы. Для мультисистемной атрофии характерны ортостатическая гипотензия и недержание мочи (полное или частичное). У мужчин также развивается эректильная дисфункция, у женщин – снижение чувствительности клитора с аноргазмией. Нередко отмечаются склонность к запорам, дискомфорт в животе, метеоризм, слюнотечение.
- Мозжечковые нарушения. Появляется характерная атаксия ходьбы (неустойчивая неравномерная походка широко расставленными ногами), атактическая дизартрия (нарушение плавности и четкости речи, со скандированным или «взрывным» характером произнесения слов, на фоне общего замедления и приглушенности звукопроизводства), постоянный нистагм, нарушение координации движений конечностей.
У пациентов с мультисистемной атрофией рано появляются падения, что объясняется комбинацией паркинсонизма, мозжечковой атаксии и ортостатической гипотензии. Это чревато получением травм. Характерны также нарушения дыхания во сне, что связано парезом мягкого неба при поражении бульбарной группы черепно-мозговых нервов и параличом абдукторов голосовых связок.
Деменция, параличи конечностей и генерализованные судорожные припадки мультисистемной атрофии не свойственны. Но у некоторых пациентов на развернутых стадиях болезни все же отмечается когнитивное снижение, возможно развитие псевдобульбарного синдрома с насильственным смехом и плачем.
Распространенность МСА
Мультисистемная атрофия – это редкое заболевание, которое тяжело диагностировать. Его распространенность в мире 3-5 случаев на 100 000 человек.
В России мультисистемная атрофия, при которой идет полисистемное вырождение (дегенерация) клеток мозга, встречается в 0,1 случае на 100 000 человек. Такая низкая заболеваемость приводит к мысли о гиподиагностике болезни «мультисистемная атрофия».
МСА (мультисистемная атрофия) – болезнь, которую тяжело определить после первого посещения врача. Поэтому в России заболевание с медленным отмиранием клеток мозга начинают лечить достаточно поздно. В этом случае мультисистемная атрофия уже находится в развернутой стадии.
Осложнения
К последствиям прогрессирования МСА относят урогенитальные инфекции, цистит, уретрит, воспаление почек. Бактерии могут проникнуть в кровь и вызвать сепсис. На фоне дыхательных нарушений чаще развивается пневмония, ночное апноэ.
При мультисистемной атрофии возможно поражение продолговатого мозга. Это осложняется расстройством глотательной функции, вызывает смерть из-за паралича дыхательного центра или асфиксии. Вследствие дегенеративных процессов нарушается также работа сердца, сосудистой системы, мозговое кровообращение.
Что поражается при МСА?
При мультисистемной атрофии головного мозга поражаются следующие части: базальные ганглии, мозжечок, ствол. При синдроме Шая-Дрейджера идет отмирание нейронов головного мозга в области вегетативных ганглиев. Атрофии лобных долей при МСА не встречается.
При синдроме Шая-Дрейджера появляются следующие симптомы: запор, ортостатическая гипотензия, снижение функции желез (потовых, слезных, слюнных). Синдром Шая-Дрейджера может напоминать болезнь Паркинсона.
Дегенерация при атрофии коры головного мозга и синдром Шая-Дрейжера не ведут к атаксии. К ней приводит поражение мозжечка. Походка пациента становится шаткой, случаются частые падения, нарушается координация движений рук и ног. Синдром Шая-Дрейджера может предшествовать атаксии или развиваться параллельно с ней.
Атрофии головного мозга: что это такое? Медленная гибель нейронов приводит к утрате определенных функций. При диффузной кортикальной атрофии начинается потеря слуха, зрения, слуховые галлюцинации.
Диффузная атрофия подразумевает рассеянное поражение без четкой локализации. Мозг поражается бессистемно, предсказать последствия болезни очень трудно. Шая-Дрейджера синдром и МСА характеризуются более четкой клинической картиной.
Лечение
Схема лечения при мультисистемной атрофии может включать:
- Препараты леводопы для уменьшения выраженности паркинсонизма – основная рекомендация при этом заболевании. Дают некоторый эффект на начальных стадиях заболевания, который сохраняется обычно на протяжении не более 1-2 лет. Их использование может усугубить проявления вегетативной недостаточности и не влияет на выраженность сопутствующих миоклонии и дистоний.
- Другие противопаркинсонические препараты.
- Агонисты альфа-адренорецепторов и их предшественники для коррекции артериальной гипотонии.
- Немедикаментозные меры для частичной компенсации ортостатической гипотензии. Рекомендовано ношение компрессионного трикотажа или тугое бинтование конечностей эластичными бинтами, увеличение потребления воды, повышение количества соли в рационе.
- Профилактика запоров: употребление пищи с большим количеством растительной клетчатки, при необходимости прием слабительных, использование очистительных клизм.
- М-холинолитики (толтеродин, оксибутинин и др.) для уменьшения выраженности недержания мочи.
- Катетеризация и самокатетеризация мочевого пузыря при выраженных тазовых нарушениях с неполным опорожнением мочевого пузыря.
Лечение при мультисистемной атрофии симптоматическое, направлено на смягчение основных проявлений. Патогенетической терапии пока не разработано.
Причины и симптомы атрофии головного мозга
Клиника развивается внезапно. Дегенеративные заболевания формируются в результате органического или токсического поражения нейронов коры и подкорки. Причины болезни не установлены. Наиболее вероятными факторами риска могут стать:
- Травмы головы;
- Опухолевые поражения;
- Интоксикации;
- Хроническая гипоксия;
- Сосудистые болезни.
Сколько живут люди с атрофией мозга? Выраженность заболевания зависит от количества пораженных нейронов. Средняя продолжительность жизни пациента с МСА около 5-7 лет.
Атрофия лобных и височных долей (лобно-височная деменция)
Симптомы могут несколько лет оставаться незамеченными. После появления первых клинических признаков врачи склонны думать, что у больного развивается болезнь Паркинсона.
Основные синдромы, преобладающие в клинической картине:
- Паркинсонизм;
- Атаксия;
- Вегетативная дисфункция.
Признаки разрушения клеток базальных ганглиев головного мозга: дрожание конечностей, напряжение мышц, неустойчивость при ходьбе. Медленный шаг, шаткая походка, неровный почерк – это симптомы, характерные для больного.
Атаксия формируется при поражении мозжечка. При этом страдает координация движений и способность самостоятельно передвигаться. Вегетативная дисфункция: запор, нарушение пищеварения, проблемы с мочеиспусканием и работой желез.
Классификация
Медики выделяют три формы МСА в зависимости от того, какой синдром выявляется ведущим. Если это невозможно установить, пациенту диагностируют смешанный тип болезни.
Классификация патологии:
| Ведущий симптом | Тип мультисистемной атрофии | Отличительные черты |
| Паркинсонизм | Стриатонигральный тип МСА | Замедленные движения, лицо маскообразное, застывание в одной позе, симптом «воздушная подушка», тремор конечностей, согнутость суставов, снижение подвижности. Дегенерации больше подверженстриатум, черная субстанция. |
| Вегетативная недостаточность | Синдром Шая-Дрейджера | Дисфункция желез и органов, тазовые нарушения, гипотензия, храп, апноэ. |
| Мозжечковая атаксия | Оливопонтоцеребеллярный тип МСА | Ухудшение равновесия, нарушение мелкой моторики, непроизвольное движение глазных яблок, мышечная слабость. Дегенерации больше подвержен мозжечок, мост, оливы. |
В классификаторах врачи предлагают убрать синдром Шая-Дрейджера, поскольку вегетативная недостаточность сопровождает все формы МСА. В МКБ-10 указан только мозжечковый и паркинсонический тип болезни.
Этиология и патогенез
Этиология множественной системной атрофии неизвестна. Ученые предполагают, что отмирание нейронов мозга связано с накоплением альфа-синуклеина. Этот белок откладывается в тканях вещества головного мозга и нарушает проводимость нервного импульса. Причины накопления вещества при множественной системной атрофии неизвестны.
Что такое атрофия головного мозга? Причина появления множественной системной атрофии не установлена. Есть предположения о генетическом происхождении заболевания. Выявлены семейные случаи патологии. Мутация обнаружена в 19-ой хромосоме, как маркер множественной системной атрофии.
Патогенез отмирания клеток головного мозга у пожилых: в клетках глии откладываются молекулы альфа-синуклеина и тау-белка. Скопление патологической субстанции в олигодендроглиоцитах затрудняет межнейрональное взаимодействие. Страдает пирамидная, экстрапирамидная системы, моторная кора и мозжечок.
Базальные ганглии также могут поражаться, когда атрофирован мозг. Идет дегенерация скорлупы. Паркинсонизм при мультисистемной атрофии проявляется при поражении этих структур. Мозг при МСА атрофирован в определенной локализации. Подобные изменения видны только на ПЭТ.
О заболевании
Множественной системной (мультифокальной, мультисистемной) атрофией называют обширную дегенерацию глиальных клеток во всех структурах головного мозга (ГМ). Сокращенно болезнь записывают МСА или MSA. Мультисистемная атрофия быстро прогрессирующее тяжелое заболевание, при котором в патологический процесс часто вовлекается спинной мозг, приводя к уменьшению тканей центральной нервной системы инвалидности.
Дегенерация провоцирует появление:
- слабоумия;
- дрожательного паралича — синдром паркинсонизма;
- дисфункциивегетативной нервной системы;
- атаксии мозжечка — расстройство двигательной и речевой функции;
- недостаточности пирамид — нарушается работа ЦНС.
Справка! МСА является редкой неизлечимой патологией, встречается преимущественно у мужчин. Заболеваемость составляет менее 6 случаев на 100000 населения.
Во время развития болезни поражаются подкорковые ядра (базальные ганглии) внутри полушарий ГМ.Они расположены между промежуточным мозгом и лобными долями. Состоят из полосатого тела, серого и белого вещества, нигральной (черной) субстанции, субталамического ядра. На гистологическом исследовании в олигодендроглиоцитах обнаруживаются накопления альфа-синуклеина во включениях цитоплазмы. Это несвойственно составу клеток нейроглии.
В результате дегенерации подкорковых ядер нарушается:
- координация движений;
- регуляция мышечного тонуса;
- чувствительность восприятия зрительных, слуховых и прочих раздражений;
- регулирование трофики, обмена, дыхания, мочеиспускания, иных вегетативных функций;
- выработка рефлексов, память, другая регуляция высшей нервной деятельности.
МСА чаще выявляют у людей старше 50 лет, которые работали с вредными и токсическими веществами, пестицидами, формальдегидом, растворителями. В группе риска состоят пациенты с болезнью Паркинсона, Альцгеймера. Опасность заключается в том, что патология вызывает необратимый процесс в мозге с гибелью нервных клеток. С момента появления симптомов длительность жизни не превышает 15 лет. Смерть чаще наступает вследствие нарушения дыхания или сепсиса.
Рисунок 1. Отображение мозга при томографии
До 2021 года в МКБ―10 мультисистемная атрофия была причислена к коду G90.3 под названием «полисистемная дегенерация». Сейчас в справочнике остался паркинсонический тип МСА под шифром G23.2 «MSA-P» и мозжечковый – G23.3 «MSA-C». В МКБ-10-КМ патология о под номером G90.3.
Клинические разновидности и классификация
Мультисистемная атрофия имеет несколько синдромов, которые развиваются одномоментно или следуют друг за другом. В клинической картине может преобладать один из них. МСА страдают только взрослые, атрофия мозга у ребенка не проявляется. Выделяют следующие варианты развития болезни:
- МCA с преобладанием вегетативной клиники (синдромом Шея-Дрейджера);
- МCA с преобладанием паркинсонизма (стриатонигральные атрофические поражения головного мозга);
- МCA с мозжечковым синдромом (оливопонтоцеребеллярная дегенерация.
Мультисистемная атрофия при синдроме Шая-Дрейджера проявляется запорами, поносами, нарушением функции мочеполовой системы, работы желез. Отличительной чертой синдрома Шая-Дрейджера является ортостатическая гипотензия. При болезни пациент быстро «теряет» давление и часто падает в обмороки. Лечения синдрома Шая-Дрейджера применяются препараты для повышения давления.
Паркинсонический вариант значительно отличается от синдрома Шая-Дрейджера. При стрианигральной умеренной атрофии появляются классические симптомы болезни Паркинсона: медленная шаркающая походка, тремор, ригидность мускулатуры. Отмирание клеток мозга при этой болезни не затрагивает белого вещества головного мозга, и атрофия не приводит к деменции.
Третий вариант множественной системной атрофии – это атаксическая клиника болезни. Для нее характерно поражение мозжечка и стволовых отделов. Диффузной атрофии головного мозга не наблюдается. При множественной системной атрофии поражаются структуры только определенной локализации. ОПЦА характеризуется шаткой походкой, ранними падениями, нарушением координации.
Итак, характерные признаки множественной системной атрофии:
- Не характерна атрофия головного мозга у детей, страдают только люди после 60 лет;
- Для болезни не развивается корковая атрофия (что такое атрофия коры головного мозга читайте выше);
- Атрофические изменения головного мозга происходят не диффузно. Все очаги локализованы в подкорковых структурах;
- Нет критического поражения сосудов головного мозга. Болезнь начинается спонтанно и ее причина не установлена.
Мультисистемная атрофия головного мозга имеет код по МКБ 10 – G90.3.
Определяют болезнь по особенной клинической картине и данным МРТ (провести исследование можно в медицинском центре в Тушино, Аэродромная, 5). Отзывы о качестве обследования самые высокие.
Диагностика
Диагностика мультисистемной атрофии основывается на анализе клинической картины и данных нейровизуализационных методик. При этом обязательным признаком является наличие вегетативной недостаточности, что подтверждается специальными клиническими тестами и суточным мониторингом уровня артериального давления. Достоверной и доступной лабораторной диагностики этого заболевания на данный момент пока не разработано.
МРТ головного мозга может выявить ряд характерных признаков:
- Изменение интенсивности сигнала от скорлупы и бледного шара, атрофия скорлупы, появление гиперинтенсивной (в режиме Т2) щелевидной полоски по наружному краю скорлупы.
- Атрофия ствола и мозжечковых структур. Изменения захватывают червь, кору полушарий, средние ножки мозга, основание моста.
Определенный (полностью достоверный) диагноз возможен лишь при патоморфологическом посмертном исследовании нервной ткани. Признаками заболевания служат плотные глиальные цитоплазматические включения и дегенеративные изменения в оливопонтоцеребеллярной и нигростриарной области.
Степени болезни и диагностика
При мультисистемной атрофии выделяют определенного 2 типа болезни (msa-p, msa-n). Имеется 3 степени тяжести. При легкой степени симптомы практически не выражены. Могут появляться признаки тремора, неустойчивости походки. Клиники недостаточно для выставления диагноза.
На средней степени преобладает клиника одного из синдромов. Проявления болезни хорошо заметны и значительно затрудняют жизнь пациента. Врач проводят диагностику, лечение и оформления группы инвалидности. При тяжелой степени больной прикован к постели, нуждается в постоянном уходе.
Характерных признаков атрофии головного мозга при МСА на мрт не существует. Врачи рекомендуют использовать для диагностики аппараты не менее 1,5 Тесла. При этом на начальных стадиях патологию сложно отличить от болезни Паркинсона. Более точную локализацию поражения и наличие очагов деструкции зон, типичных для МСА, дает ПЭТ и ОЭКТ.
Диагностика мультисистемной атрофии сложна и невозможна без других тестов:
- Кардиоваскулярные тесты (ортостатическая гипотензия, низкое давление и чсс, брадикардия);
- Тест терморегуляции;
- Электрофизиологическое исследование.
Характерных специфических признаков мультисистемной атрофии на МРТ нет. Определяют типичные изменения: аномалии в области базальных ганглиев, «крест» в области варолиева моста, дегенерация моста и мозжечка.
Лечение мультисистемной атрофии
Заболевание не имеет специфического лечения. Сложно остановить или замедлить прогрессирующую нейродегенерацию. Но врачи могут помочь справиться с симптомами болезни. Для этого используются несколько групп препаратов. Посиндромно разберем терапию МСА.
Паркинсонизм
Симптомы паркинсонизма купируют препаратами, которые применяются при болезни Паркинсона (Левадопа). Через несколько лет эффективность средств снижается. В этом случае они не показаны для лечения атрофии головного мозга.
| Симптом | Препараты первой линии | Альтернативные средства |
| Брадикинезия, тремор, нарушение постуральной устойчивости, ригидность мышц. | Левадопа. Когда пациент хорошо переносит лекарства, его дозировку повышают до 1 грамма в сутки. | При плохой переносимости используются амантадины, агонисты дофаминовых рецепторов. |
Несмотря на высокую дозировку препарата, меньше половины пациентов реагируют на назначение Левадопы. Плохой ответ дают и агонисты дофаминовых рецепторов. Кроме того, такие назначения усугубляют ортостатическую гипотензию, приводят к возникновению галлюцинаций и дискинезий.
Использование амантадинов, особенно в инъекционной форме, может оказывать положительный эффект при меньшей выраженности последствий терапии. Однако, ученые рекомендуют продолжить исследования о пользе применения этого лекарства у больных МСА.
Сокращение объемов жидкости в организме
Мультисистемная атрофия с проявлениями ортостатической гипотензии корригируется диетой, ношением абдоминального бандажа и компрессионного трикотажа. Лечение заключается в расширенном питьевом режиме, употреблении соли. Это позволяет сохранять давление и избегать обмороков с падениями.
Использование кровати с высоким изголовьем тоже показало пользу в предотвращении понижения давления во время сна и отдыха. Разработана и лекарственная терапия, купирующая эти опасные состояния.
| Симптом | Терапия первой линии | Альтернативная терапия |
| Ортостатическая гипотензия, обмороки, головокружения. | Мидодрин Дроксидопа | Флудрокортизон Десмопрессин |
Мидодрин является альфа-адреномиметиком. Его основные свойства – увеличение тонуса сосудов и повышение артериального давления. Таблетки принимают внутрь. Начальная терапевтическая доза – 2,5 мг. Ее увеличивают до 5 мг 2-3 раза в день. Побочными эффектами мидодрина являются гипертензия, повышение давления лежа, брадикардия, изжога, сухость во рту, «гусиная» кожа, проблемы с мочеиспусканием.
Дроксидопа или L-DOPS. Торговое название лекарственного средства Нортера. Это предшественник норэпинефрина. Основные фармакологические свойства – повышение тонуса сосудов и артериального давления. Рекомендован к использованию FDA. В отличие от препаратов предыдущего поколения, Дроксидопа имеет меньшее количество побочных эффектов и хорошо переносится пациентами. Самые частые негативные проявления лечения – это тахикардия, гипертензия, головная боль с тошнотой и рвотой. Они появляются крайне редко.
Флудрокортизон. Минералокортикоид, который может применяться при уменьшении объема жидкости в организме. Основное свойство – повышение артериального давления. Препарат выпускается в инъекционной и таблетированной форме. При низком давлении лучше использовать пероральные препараты. Побочные эффекты флудрокортизона типичны для минералокортикоидов. Это повышение давления, периферические отеки, гипернатриемия и гипокальциемия.
Десмопрессин. Вещество оказывает антидиуретический эффект. Препятствует излишнему выделению жидкости вместе с мочой, поддерживает артериальное давление. Применяется внутривенная, внутримышечная и подкожная форма введения.
Нарушение функций глотания
У некоторых пациентов при прогрессировании заболевания появляются проблемы с глотанием. Компенсировать это состояние помогают жидкие пищевые смеси, гомогенизированная еда.
При полном прекращении глотания необходимо устанавливать пищевые трубки для назального кормления или выполнять гастростомию. В этом случае пищу по катетеру доставляют прямо в желудок. Возможно парентеральное кормление, когда питание дают внутривенно.
Для профилактики нарушения глотательной функции применяется речевая гимнастика. Упражнения позволяют мобилизовать резервные возможности организма и отсрочить осложнения.
Недержание мочи
В результате нарушения иннервации тазовых нервов у пациентов развивается недержание мочи. Для преодоления состояния используются антихолинэргические препараты. Оксибутинин или толтеридин позволяют контролировать функции мочевого пузыря.
Оксибутинин – препарат м-холинолитик. Он позволяет уменьшать произвольные и непроизвольные позывы к мочеиспусканию, лучше контролировать функцию мочевыделения. Таблетки принимают внутрь. Есть возможность долгосрочного применения до 2 лет.
Если при консервативном лечении мультисистемной атрофии наступает острая задержка мочи, то прибегают к катетеризации. Для профилактики нарушений эффективна гимнастика мышц тазового дна, лфк, использование техники биологической обратной связи.
Биологическая обратная связь – это мониторинг физиологических показателей и сознательное управление ими с помощью специальных мультимедийных устройств. Сложность лечения недержания состоит в том, что выполнение специальных упражнений затруднено глубоким расположением мышц.
Многие пациенты не могут эффективно их сокращать, напрягая мускулы-антагонисты, которые повышают внутрибрюшное давление. И проблема только усугубляется.
Занятия с БОС-процедурой заключается в использовании специальных ректальных и вагинальных датчиков. Они регистрируют тонус необходимой мускулатуры, стимулируют ее и позволяют человеку осознанно сокращать ее самостоятельно. БОС процедуры проводятся курсом по 15 дней. Их следует повторять 2-3 раза в год.
Запор
При возникновении проблем с опорожнением кишечника рекомендуется принимать пищевые волокна. Они усиливают моторику и стимулируют перистальтику. В тяжелых случаях можно использовать слабительные препараты (лактулоза, таблетки сенны, макрогол).
Апноэ
При частых апноэ во сне (кратковременной остановке дыхания) можно применять аппараты СИПАП (CPAP). Они позволяют проводить режим искусственной вентиляции с легких постоянным положительным давлением. СИПАП-аппарат представляет собой компрессор. Поток воздуха непрерывно передается через воздуховод в маску больного. Сон в маске способствует уменьшению утренней усталости, сонливости, тяжести в голове.
Импотенция
Для восстановления нормальной половой функции допустимо использовать препараты Силденафил, Тадалфил. Однако, их следует рекомендовать только при хорошем самочувствии пациента. Ведь они могут понижать давление и вызывать слабость.
Дистония
В редких случаях у пациентов возникает дистония. Постоянный спазм мышц затрагивает антагонистичные группы. В результате у пациента формируются неудобные и причудливые позы, которые ведут к потере нормальной жизнедеятельности и хронической боли в пораженных мускулах.
Для купирования этого состояния можно использовать инъекции ботулотоксина. Введение вещества расслабляет мускулатуру и убирает локальную болезненность. Курс инъекций составляет около 7 процедур. Препарат действует несколько месяцев. После этого уколы требуется повторить.
Нарушения сна и миоклонус
Известно, что у при МСА развиваются нарушения сна в быстрой фазе. Пациент ведет себя беспокойно, может двигать руками и ногами, совершать другие действия. Это может привести к травмам, нарушению ночного отдыха. Поэтому используется группа седативных препаратов, способствующих нормализации сна. Применяются клонозепам, мелатонин, антидепрессанты.
Физиотерапия, реабилитация и лфк
Физиотерапия позволяет пациенту расширить двигательную активность, избавиться от спазма и перенапряжения мускулатуры. Для этого используют магнитно-лазерную терапию, электропроцедуры (стимуляция низкочастотными волнами, интерференцией волн).
Лечебная гимнастика и массаж увеличивают активность пациента и препятствуют возникновению контрактур в суставах. Регулярные занятия улучшают настроение больного, препятствуют застою крови, восстанавливают микроциркуляцию.
Занятия можно проводить как при сохранной двигательной функции, так и на стадии постельного режима. Курс упражнений разрабатывает специалист. Широкое использование средств технической реабилитации (кресел-колясок, ходунков, скутеров) позволяет длительно поддерживать социализацию и бытовую активность.
Мультисистемная атрофия неизлечима. Пациентам часто предлагаются шарлатанские методики терапии. Например, Макеенко Т. «Лечение болезни мухоморами».
Помните, лечение мухоморами не имеет научного обоснования. Грибы токсичны, отравляющую дозу для пожилого организма рассчитать трудно. Если Макеенко Т. предлагает такую методику, стоит усомниться в его профессионализме.
Глава 2. «Мультисистемная атрофия»
Книга: «Редкие неврологические синдромы и болезни» (В.В. Пономарев)
Мультисистемная атрофия (MCA; множественная системная атрофия) в настоящее время относится к числу спорадических нейродегенеративных заболеваний группы паркинсонизм-плюс, в основе которых лежит нарушение метаболизма внутриклеточных белков с их последующим накоплением и агрегацией в определенных группах нейронов. Термин MCA впервые предложен J. Graham и D. Oppenheimer в 1969 г. Ранее клинические варианты MCA описывались под названиями оливопонтоцеребеллярная атрофия, стриатонигральная дегенерация и синдром Шая—Дрейджера [1]. Заболевание развивается в среднем и пожилом возрасте и характеризуется сочетанием паркинсонизма, вегетативной недостаточности, мозжечкового и пирамидного синдромов, а также других симптомов: пареза взора вниз, деменции подкоркового типа, миоклоний [4, 5].
Частота MCA составляет 1,9—4,4 случая на 100 ООО населения, т. е. встречается в 20 раз реже, чем болезнь Паркинсона. В структуре всех случаев паркинсонизма MCA составляет 5—10% [2]. В настоящее время установлена нозологическая самостоятельность MCA, которая имеет единую этиологию, патогенез и патоморфологию, но различается локализацией поражения мозга. Последнее обстоятельство обусловливает значительный полиморфизм клинических проявлений и делает каждый случай заболевания при схожести основных симптомов уникальным. Приводим собственные наблюдения.
Больная J1., 51 год, председатель профкома крупного предприятия. Заболела 5 лет назад, когда на фоне постоянных стрессов и начала гормональной перестройки появились повышенная потливость, приливы жара, онемение и синюшность пальцев рук, затруднение речи по типу дизартрии. Речевые нарушения возникали при волнении. Очаговых нарушений в неврологическом статусе тогда не было обнаружено. Лечение в неврологическом отделении и психотерапия эффекта не дали. На фоне вегетативной неустойчивости постепенно прогрессировали речевые нарушения и шаткость походки. Спустя 2 года из-за нарушения равновесия впервые упала и получила закрытую черепно-мозговую травму легкой степени. С этого времени стала отмечать недержание мочи при смехе, волнении. Через 3 года присоединились пропульсии при ходьбе, участились падения, изменился почерк, стала испытывать неловкость в пальцах рук при выполнении точных движений. Спустя еще год падения стали практически ежедневными, ухудшилась речь, иногда стала поперхиваться при приеме твердой пищи, с трудом выполняла свою работу. Образование высшее. В семье и среди ближайших родственников заболеваний нервной системы не было.
Объективно при поступлении: общее состояние удовлетворительное, пульс 72 уд/мин, АД 120/80 мм рт. ст. Ортостатическая проба положительная (при проведении пробы АД снизилось до 90/60 мм рт. ст.). Отмечается синюшность концевых фаланг кистей, которые усиливаются на холоде. Соматический статус компенсирован. Неврологически: в сознании, ориентирована, эйфорична, насильственный смех и плач. Глазодвигательных нарушений, нистагма нет. Небные занавески симметричны, глоточный рефлекс снижен. Резко выражены рефлексы орального автоматизма (хоботковый рефлекс, Маринеску— Радовича). Речь скандированная с элементами дизартрии и дисфонии. Объем движений в конечностях полный. Мышечных атрофий нет. Сила достаточная. Мышечный тонус повышен по типу «зубчатого колеса», больше справа.
Сухожильно-периостальные рефлексы высокие, зоны расширены, S=D, патологический симптом Бабинского с двух сторон. В позе Ромберга неустойчива, в усложненной пробе падает. Пальце-носовую пробу выполняет с легкой интенцией и промахиванием. Выраженная интенция и дисметрия при выполнении пяточно-коленной пробы. Походка с широко расставленными ногами, мелкими шажками с пропульсией. Легкая гиперестезия в пальцах стоп.
При обследовании: общеклинические анализы крови, мочи, биохимический анализ крови без патологии. Окулист: острота зрения 1,0, глазное дно без патологии. МРТ головного мозга: равномерно расширены борозды полушарий мозга и мозжечка, расширена желудочковая система.
Таким образом, у больной заболевание началось в возрасте 46 лет, медленно прогрессировало и через 5 лет имело все признаки MCA: сочетание мозжечкового, пирамидного, экстрапирамидного синдромов и вегетативной недостаточности. Болезнь дебютировала вегетативными расстройствами (синдром Рейно, приливы жара, потливость), что первоначально объяснялось периодом гормональной дисфункции. В последующие 3 года вегетативные нарушения прогрессировали, появились ортостатическая гипотензия, недержание мочи. Через год присоединились мозжечковые нарушения и расстройство речи, а также паркинсонический синдром и постуральная неустойчивость. Дальнейшее прогрессирование заболевания привело к вовлечению в процесс корково-ядерных путей, что сопровождалось формированием псевдобульбарного синдрома (насильственные эмоции, дизартрия). Пирамидные нарушения проявились лишь гиперрефлексией и патологическими знаками. Препараты леводопы незначительно снизили мышечный тонус, однако гипокинезии и пропульсии сохранялись. При катамнестическом наблюдении: спустя 6 лет внезапно умерла дома от острой сердечной недостаточности.
Больная С., 54 года, инженер, при поступлении жаловалась на выраженную скованность, затруднения при самообслуживании и передвижении, частые падения, общую слабость, сухость во рту, изменение речи, недержание мочи. Больна 3,5-4 года, когда постепенно появились пошатывание при ходьбе, замедленность движений в правой руке. Спустя год присоединились аналогичные проявления в ногах и левой руке, из-за общей скованности изменилась походка. Диагностирована болезнь Паркинсона, назначены леводопосодержащие препараты, которые способствовали некоторому улучшению самочувствия. Через 1,5 года присоединились изменения речи, постуральная неустойчивость, недержание мочи, стала часто падать. При попытке встать отмечены обморочные состояния и низкое АД. Увеличение дозы леводопы привело к улучшению, однако через 3 года развились выраженные моторные флюктуации в форме феномена «включения-выключения». Объективно при поступлении: общее состояние больной удовлетворительное, кожные покровы сухие, кисти рук холодные, пульс фиксированный 74 уд/мин, АД 100/70 мм рт. ст.
Ортостатическая проба положительная (АД при пробе снизилось до 60/40 мм рт. ст). Соматической патологии не выявлено. Неврологически: в сознании, ориентирована, быстро истощаема, плаксива. Память снижена, мышление замедлено (брадифрения). Глазодвигательных нарушений нет. Лицо амимично. Голос тихий, дизартрия, дисфония. С трудом высовывает изо рта язык. Выражены рефлексы орального автоматизма.
Сила в конечностях достаточная. Мышечный тонус резко повышен по пирамидному типу, больше в правых конечностях. Сухо-жильнопериостальные рефлексы высокие, зоны расширены, D>S, рефлекс Бабинского справа. Чувствительность сохранена. Координаторные пробы не выполняет из-за общей скованности. Поза согбенная, «просителя», передвигается по палате только с посторонней помощью.
Обследование: общеклинические анализы крови, мочи, био-химические исследования без отклонений от нормы. Окулист: острота зрения 0,6/0,6 с коррекцией 1,0, миопический конус, глазное дно без патологии. МРТ головного мозга в T2w режиме: выявлены зоны снижения интенсивности сигнала в области скорлупы.
В приведенном наблюдении на всем протяжении болезни доминировал экстрапирамидный синдром, плохо поддаваясь терапии леводопосодержащими препаратами. Легкие мозжечковые проявления были отмечены только в дебюте болезни. Пирамидный и псевдобульбарный синдромы, а также вегетативная недостаточность в клинической картине представлены весьма деликатно и маскировались грубыми паркинсоническими проявлениями. Состояние больной прогрессивно ухудшалось, и она умерла спустя 5 лет от начала заболевания.
Таким образом, в представленных наблюдениях MCA проявлялась четырьмя ведущими синдромами: мозжечковым, паркинсоническим, пирамидным и вегетативным, однако их выраженность и очередность проявления существенно различались. По мере прогрессирования заболевания каждый из перечисленных синдромов мог стать ведущим, маскируя другие проявления. Только тщательный сбор анамнеза и неврологический осмотр позволили выявить характерную для MCA клиническую картину.
В последние годы получены новые данные о патогенезе MCA. Установлено, что MCA относится к группе синуклеинопатий и по механизму развития схожа с болезнью Паркинсона, деменцией с тельцами Леви, болезнью Галлервордена—Шпатца, связанных с мутацией в гене альфа-синуклеина на 4-й хромосоме. В норме белок альфа-синуклеин состоит из 140 аминокислот, присутствует в пресинаптических терминалях головного мозга человека, хорошо растворим и не связан с другими белками [3]. Изменения внутриклеточного гомеостаза приводят к его полимеризации, накоплению и агрегации преимущественно в глиальных клетках, что в конечном итоге способствует апоптозу (программированной смерти).
Нозологическая самостоятельность MCA доказана в 1989 г., когда в олигодендроцитах у больных с различными вариантами MCA были обнаружены аргирофильные глиальные цитоплазматические включения (ГЦВ). Позже подобные включения обнаружены в ядрах глиальных клеток и ядрах нейронов [3]. Установлено, что основой ГЦВ является нерастворимая форма альфа-синуклеина, образующего свободно соединенные между собой нитевидные структуры диаметром 20—40 нм. Предполагают, что при MCA усиление продукции данного белка может происходить под влиянием некоторых внешних факторов, утраты способности клеток к его метаболической деградации из-за явлений конформации [2, 4]. Общий механизм патогенеза позволил отнести MCA к группе конформационных болезней ЦНС, к которой в настоящее время относятся также амиотрофический боковой склероз, болезнь Альцгеймера, прогрессирующий надъядерный паралич, болезнь Крейтцфельда— Якоба и ряд других заболеваний.
Отличительной особенностью MCA является первичное поражение клеток глии, доминирующей над изменениями нейронов. Для MCA характерно избирательное поражение глии в стриатуме, черной субстанции, голубом пятне, нижних оливах, ядрах моста, коре мозжечка, дорсальном ядре блуждающего нерва, клетках боковых рогов [4]. Причина подобной избирательности объясняется неодинаковой чувствительностью нейронов, связанной с различным содержанием железа. Известно, что в базальных ганглиях при MCA содержание железа повышено, причем ведущую роль в регуляции железа в головном мозге играют именно олигодендроциты. При MCA в них образуется железосодержащий пигмент [6]. Избирательная чувствительность к нейродегенеративному процессу может зависеть и от содержания других внутриклеточных белков. Недавно установлено, что в клетках Пуркинье у больных с MCA резко снижено содержание кальцийсвязывающих белков кальбинина и парвальбумина, но повышено содержание белка Вах, способствующего развитию апоптоза [7].
Несмотря на то что большинство нейродегенеративных заболеваний носит наследственный характер либо имеет наследственную предрасположенность, при MCA не описано семейных случаев. Не выявлено также мутаций в кодирующей зоне гена альфа-синуклеина на хромосоме 4 и иных генетических изменений. Однако нельзя исключить, что к развитию MCA предрасполагает определенное сочетание аллелей нескольких генов (синфиллина-1, чаперонов, протеинкиназы С). Возможно, генетические факторы предопределяют повышенную чувствительность ЦНС к внешним токсическим воздействиям окружающей среды [5].
Дифференциальный диагноз MCA проводится с болезнью Паркинсона, вторичным паркинсонизмом, болезнью Альцгеймера, мозжечковыми атаксиями. Этиологической и патогенетической терапии MCA нет, поэтому главная задача невролога — ее правильная и своевременная диагностика. Точный диагноз позволяет выбрать оптимальную лечебную тактику, избежать применения сложных и ненужных методов обследования, а также сильнодействующих лекарственных средств и связанных с ними осложнений. На первое место выходит симптоматическая терапия. При акинетикоригидном синдроме показано назначение препаратов леводопы (мадопар 425—550 мг/сут). В случае прогрессирующей вегетативной недостаточности, не поддающейся коррекции немедикаментозными способами, эффективны кортинефф 200 мг (2 табл.) или гутрон 5 мг (2 табл.) в утренние часы. При повышении мышечного тонуса пирамидного типа назначают баклофен (75 мг/сут) или мидокалм (150-300 мг/сут). Новые подходы в терапии MCA, по данным О. Левина [2], могут заключаться в следующем:
• в стабилизации нативной конформации клеточных белков; • в предупреждении образования агрегатов и сборки нейро-фибрилл; • в растворении образовавшихся агрегатов; • в воздействии на вторичные цитотоксические процессы (митохондриальная дисфункция, оксидантный стресс, гиперпродукция оксида азота, активация микроглии, механизмы апоптоза).
Таким образом, MCA является одной из редких форм конформационных нейродегенеративных заболеваний нервной системы со сложными и до конца неясными механизмами развития. Клиническая картина MCA имеет широкий полиморфизм симптомов и прогрессирующее течение. Лечение заболевания консервативное, синдромологическое. Прогноз неблагоприятный.
Клинические исследования
Несмотря на то что МСА является малоизученной и смертельной болезнью, ученые продолжают изучение этой нейродегенерации. В 1999 году было основано Европейское общество по изучению МСА. Это консорциум исследователей и научных центров Европы и Израиля. Он занимается клиническими испытаниями и научными исследованиями, позволяющими расширить знания о тяжелых неврологических патологиях.
Основная цель EMSA-SG – расширить знания об этиологии и патогенезе болезни. Группа использует поддержку спонсоров, внедряет разработки по лечению симптомов болезни. Обмен информации идет с исследовательской группой из Северной Америки, Китая, Японии.
Открытия, сделанные в сфере изучения нейродегенеративных болезней:
- Альфа-синуклеин, который был выделен из мозга пациентов МСА, являлся индуктором этого белка у здорового лабораторного животного. По сути дела, он вел себя как инфекционный агент. Сейчас ведутся разработки препарата или процесса, который поможет останавливать это распространение;
- Ученые связали болезнь с митохондриальными повреждениями. Так, на моделях было продемонстрированно, что накопление альфа-синуклеина и митохондриальная «поломка» приводят животное к развитию МСА;
- Ведутся разработки маркеров и тестов, которые позволят быстро диагностировать болезнь, а также контролировать ее течение;
- Большое внимание уделяется созданию реестра больных с нейродегенеративными заболеваниями. Такое исследование лучше позволяет понимать происхождение МСА, наследование, влияние природных, экологических и производственных факторов;
- Разрабатываются новые препараты для терапии болезни. Недавнее исследование показало неэффективность применения рифампицина для лечения симптомов МСА.
Активно идет разработка ранних биомаркеров нейродегенеративных заболеваний, создается общая база исследовательских работ по этой болезни. Ознакомится с ними можно по ссылке.
Врачи
В терапии МСА используется мультидициплинарный подход. Пациентом занимается целая группа врачей. Специалисты по двигательным расстройствам, по сердечно-сосудистой системе, урологи, гастроэнтерологи, сомнологи, пульмонологи, лоры, физиотерапевты, эрготерапевты, инструкторы лфк.
Специалисты по двигательным расстройствам занимаются проблемами нарушения работы нервной системы при таких болезнях, как Паркинсон, МСА и другие. В отечественной медицине выделяют специальность врач-паркинсонолог (экстрапирамидолог). Этот специалист обладает широкими знаниями в отношении этого типа заболеваний, имеет опыт работы и лечения таких пациентов. Этим он отличается от невролога.
При ортостатической гипотензии требуется консультация кардиолога. Он поможет подобрать препарат, который позволит избегать слабости и обмороков в вертикальном положении. При проблемах с глотанием и речью пациента должен проконсультировать лор-врач. А также эффективны занятия у логопеда при начальных проблемах с дикцией. Он подскажет курс упражнений, которые требуется выполнять для поддержки этой области.
Проблемы при МСА затрагивают почти все отделы. Только совместный труд узких специалистов гарантирует пациенту качественную помощь. Однако, чаще всего больной контактирует с врачом общей практики. Его знания и своевременные консультации узких специалистов позволяют пациенту быстро справляться с новыми симптомами.
Лечение мультисистемной атрофии головного мозга России проводится в клиниках в отделении неврологии и в частных центрах. Доктора, лечащие мультисистемную атрофию в Москве, консультируют в ФГБНУ «Научный центр неврологии». Запись на платной основе или по направлению местного учреждения здравоохранения.
В клиниках Израиля применяются новаторские технологии лечения мультисистемной атрофии головного мозга мезенхимальными текальными стволовыми клетками. С пациентом также работают физиотерапевты, логопеды и специалисты в области сна. Применение лечения стволовыми клетками при мультисистемной атрофии головного мозга находится в стадии апробации.
Вопросы, связанные с завершением жизни
Пациенты с МСА в исходе заболевания утрачивают двигательные навыки. Они требуют ежедневного ухода. Нуждаются в посторонней помощи для выполнения базовых потребностей. За рубежом пациенты заранее оговаривают, какую им требуется оказывать помощь при развитии недееспособности.
В нашей стране забота о терминальном пациенте, как правило, ложится на плечи родственников. Однако, непрофессионалы не могут создать для больного качественный уход. Ко всему прочему, такой режим вызывает «синдром эмоционального выгорания». Ведь чаще всего уход за больным членом семьи не освобождает их от выполнения профессиональных обязанностей.
Другие варианты ухода за терминальным пациентом:
- Хосписы. Доступны при наличии свободных мест. Есть возможность платной госпитализации. Из минусов учреждения – невозможность контролировать качество ухода за больным;
- Профессиональные сиделки. Для круглосуточного ухода требуются высокие затраты;
- Частные дома для престарелых.
Причины развития
Ученые продолжают изучать причины, механизм развития и провоцирующие факторы МСА. Однозначного подтверждения нет о наследственной предрасположенности к развитию болезни. У ребенка врожденная атрофия ГМ бывает при злоупотреблении женщины во время беременности лекарствами, спиртным, наркотиками.
В ходе диагностики врачи выявляют возможные причины мультисистемнойатрофии:
- болезнь Паркинсона либо Альцгеймера;
- контакт с нейротоксическими веществами;
- изменчивость гена «α-синуклеин»;
- отравление алкоголем, наркотиками у людей с зависимостью;
- травма головного и/или спинного мозга;
- гипоксия тканей ГМ.
Патогенез плохо поддается изучению, поскольку неизвестны точные причины мультисистемной атрофии. В ходе исследований обнаружено накопление тау-протеинав пораженных олигодендроглиоцитах. Это выявляют в мозжечке, пирамидах, коре ГМ, рогах спинного мозга в области грудного и крестцового отдела хребта. Одновременно повреждаются дофаминовые рецепторы, черная субстанция, скапливаетсяα-синуклеин в нейроглиальных клетках.
Справка! МСА характерно асимметрическое уменьшение белого вещества, нарушение передачи нервных импульсов. Нейроны страдают меньше олигодендроглиоцитов.
Как быть семье больного?
Болезнь прогрессирует, и пациенту требуется уход. Первыми появляются проблемы с глотанием жидкой или твердой пищи, нарушается самостоятельное передвижение и контроль за мочеиспусканием и дефекацией. Родственники больного могут столкнуться со следующими проблемами:
- Оформление группы инвалидности;
- Получение социальной помощи;
- Поиск информации по уходу за пациентом.
Можно определить пациента в дом престарелых, где квалифицированный персонал будет ухаживать за больным. Пансионаты для людей с такой болезнью работают на платной основе, сутки пребывания стоят от 1500 рублей.
Ссылка на европейскую группу поддержки больных с МСА, а так же, истории из жизни пациентов на русском и других языках.
Важно! Форум о мультисистемной атрофии позволяет не только получить информацию о болезни и методах лечения. Ухаживающим приходится сталкиваться с эмоциональными переживаниями, которыми лучше делиться с понимающими людьми.
2.Причины
Нам выпало жить в эпоху, когда стремительное развитие медицинской науки неуклонно сокращает число как неизлечимых болезней, так и болезней непонятных, этиологически неясных. Мультисистемная атрофия относится и к тем, и к другим.
Несмотря на исследовательские усилия, – которые существенно затрудняются редкостью заболевания и многообразием возможных вариантов клинической картины, – этиопатогенетические факторы и механизмы мультисистемной нейронной атрофии пока не известны. Кроме того, не удается выявить статистическую значимость каких бы то ни было условий или индивидуальных особенностей, которые можно было бы назвать факторами риска и, соответственно, профилактическими мишенями. Результаты попыток дешифровать мультисистемную атрофию на хромосомном уровне до последнего времени носят гипотетический, предположительный характер. Достоверно подтверждено преобладание мужчин среди заболевших (по разным оценкам, в 1,5-2 раза), но и эта тенденция пока не получила удовлетворительного объяснения.
Посетите нашу страницу Неврология
Прогноз и продолжительность жизни
При атрофии идет отмирание коры головного мозга: сколько при этом живет человек? Никто не знает ответ на этот вопрос. От начальных проявлений до смерти при МСА проходит в среднем 3-7 лет.
Больные люди с отмиранием мозга сколько живут? Современные реанимационные системы позволяют продлить жизнь человека и без функционирующей ЦНС. Здесь встает вопрос о целесообразности такой реанимации.
Исход мультисистемной атрофии головного мозга наступает при отказе дыхательной мускулатуры. Продолжительность жизни лежачих пациентов сокращают респираторные инфекции и аспирационные пневмонии. Последствия болезни очень тяжелые (ведь что такое атрофия мозга – нарушения всех жизненно важных функций).
При мозжечковой атрофии смерть может наступить в результате травм. Продолжительность жизни при этой форме болезни колеблется от 6-9 лет (в США и Европе) до 20 лет (по данным Японии). Она зависит от генетики пациента, условий и ухода, окружающей среды и доступности медицинской помощи.
Сколько проживет человек с отмиранием коры головного мозга? Врачи прогнозируют срок жизни не более 1-1,5 лет.
Методы диагностики
Обследоваться надо у невролога. Для постановки диагноза нужно динамическое наблюдение пациента с применением церебрального МРТ. В случае противопоказаний проводят компьютерную томографию ПЭТ, ОФЭКТ.
В начале развития МСА МРТ не покажет атрофических изменений мозговой ткани, но поможет исключить опухоль, энцефалит, рассеянный склероз. Через 1―3 года интенсивной прогрессиивыявляют расширение IV желудочка, выраженную дегенерацию подкорковых ганглий, нижней половины моста, мозжечка, скорлупы.
На осмотре невролог оценивает наличие вегетативной недостаточности в комбинации спаркинсонизмоми/или дисфункцией мозжечка.
Мультисистемная атрофия не подтверждается, если:
- МСА начала развиваться до 30 либо после 75 лет;
- вегетативная недостаточность не сочетается ни с мозжечковой дисфункцией, ни с паркинсонизмом;
- патология также есть у близких родственников (семейный анамнез);
- у пациента выявлена деменция, признаки похожей на МСА болезни;
- лечение паркинсонизма эффективно лекарствами леводопы.
Для постановки диагноза ортостатической пробой исследуют функции вегетативной нервной системы. Нарушение работы тазовых структур выявляют при проведении электромиографии сфинктеров.
На развитие мультисистемной атрофии указывает наличие:
- ортостатической гипотензии — снижение давления после принятия вертикального положения;
- нерегулярного тремора;
- холодности стоп и кистей, скованности их сочленений;
- храпа, который вновь появился либо усилился;
- плача или смеха, несоответствующих переживаемой эмоции;
- тяжелых нарушений речи, голоса — дизартрия, дисфония;
- затрудненных вдохов — инспираторная одышка;
- недержания мочи;
- нарушений эректильной функции;
- кривошеи с наклоном головы к груди — антероколлис;
- непроизвольных движений мимических мышц, языка — орофациальная дистония;
- искривления позвоночника в грудопоясничном переходе с наклонением туловища вперед — камптокормия;
- учащения случаев падения;
- мозжечкового синдрома/паркинсонизма + вегетативной недостаточности.
Справка! МСА достоверно подтверждается патоморфологическим исследованием нейроглии. При жизни биоматериал с глиальными клетками получают посредством биопсии мозга или ткань изымает патологоанатом во время вскрытия.
Профилактические меры
Эффективной профилактики МСА не существует. Рекомендуются следующие меры по предотвращению дегенеративных заболеваний мозга:
- Достаточная двигательная активность в пожилом возрасте;
- Постоянная тренировка интеллектуального потенциала (чтение новых книг, изучение языков);
- Контроль соматических заболеваний (особенно сосудистых), нормализация уровня сахара;
- Отказ от работы на вредных производствах, проживания в экологически неблагоприятных зонах.
МСА – это редчайшее заболевание. К сожалению, врачи пока не могут вылечить болезнь и предотвратить ее симптомы. Однако, можно контролировать процесс развития недуга и обеспечить больному комфортные условия для жизни.
Методы профилактики
Поскольку до конца не изучены причины и патогенез МСА, специфическая профилактика не разработана. Врачи рекомендуют при работе с нейротоксическими веществами пользоваться респираторами и прочими средствами индивидуальной защиты.
Для профилактики генетической предрасположенности беременной женщине категорически запрещено курить, употреблять наркотики, алкоголь, принимать лекарства с тератогенным и эмбриотоксическим свойством. Лекарства назначает только врач по строгим медицинским показаниям.
Что нужно запомнить?
- При мультисистемной атрофии в мозге происходит необратимая дегенерация тканей центральной нервной системы.
- Причины возникновения и механизм развития продолжают исследоваться.
- В справочнике МКБ-10 оставили два типа болезни: паркинсонический и мозжечковый.
- В клинике МСА присутствуют 2―3 синдрома одновременно: вегетативная недостаточность в сочетании с мозжечковой дисфункцией и/или паркинсонизмом.
- В ходе диагностики пациента тестируют на различные виды расстройств ЦНС, делают томографию мозга.
- Лечение мультифокальной атрофии головного мозга заключается в применении симптоматической терапии.
- Сепсис, бульбарный паралич и иные осложнения МСА приводят к смерти.
- Прогноз на выздоровление отсутствует, пациент живет максимум 15 лет.
- Профилактика МСА не разработана, поскольку невыяснены причины болезни.
Литература
- Шиндряева H.H., Белова А.Н., Левин О.С. Мультисистемная атрофия — распространённость в Нижнем Новгороде. Сборник материалов научно-практической конференции «Вегетативные расстройства в клинике нервных и внутренних болезней -2009» 2009 г.
- Шиндряева H.H., Левин О.С. Вегетативные проявления у больных с мультисистемной атрофией. Сборник материалов III научно-практической конференции «Вегетативные расстройства в клинике нервных и внутренних болезней» 2010 г.
- Дамулин И.В., Яхно H.H., Гончаров O.A. Сравнительная оценка нарушений высших мозговых функций при различных типах церебральной атрофии.// Журн. неврологии и психиатрии С.С.Корсакова -1990.
- Пономарев, В.В. Редкие неврологические синдромы и болезни. -СПб. Фолиант.
- Brown RG, Lacomblez L, Landwehrmeyer BG, Bak T, Uttner I, Dubois B, Agid Y, Ludolph A, Bensimon G, Payan C, Leigh NP; for the NNIPPS Study Group (August 2010). “Cognitive impairment in patients with multiple system atrophy and progressive supranuclear palsy”. Brain. 133(Pt 8): 2382—93.
- Swan L, Dupont J (May 1999). “Multiple system atrophy”. Phys Ther. 79(5): 488—94. PMID 10331752.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th edition, (DSM IV).// Washington, DC: American Psychiatric Association, 1994.
- The Consensus Committee of the American Autonomic Society and the American Academy of Neurology (1996). “Consensus statement on the definition of orthostatic hypotension, pure autonomic failure, and multiple system atrophy”. Neurology. 46(5): 1470. PMID8628505.